
Trang chủ » Cẩm Nang Học Tập »
Bảng Tính Tan Hóa Học Đầy Đủ Của Axit, Bazơ và Muối
Bảng tính tan Hóa Học đầy đủ của của Axit, Bazơ và Muối trong trương hình Hóa Học lớp 8, 9, 10 cùng một số bài tập ví dụ hay dành cho các em học sinh.
Nội dung bài viết
I. Bảng Tính Tan Hóa Học Là Gì?
Nhắc đến Hóa, chúng ta sẽ nghĩ ngay đến bộ đôi bảng “trụ cột”, bộ đôi quan trọng bậc nhất mà dường như năm học nào các bạn học sinh cũng phải dùng đến nó, đặc biệt là các bạn học sinh THCS khi mới làm quen với bộ môn Hóa Học – đó chính là “Bảng Tuần Hoàn” và “Bảng Tính Tan”. Trong bài viết này, chúng tôi sẽ giúp các bạn có một cách nhìn tổng quan và cụ thể hơn về bảng tính tan trong Hóa Học đồng thời chỉ cho các bạn một vài mẹo để có thể ghi nhớ và vận dụng, phát huy hết tầm quan trọng của chúng một cách tối đa nhất trong quá trình học tập. Hãy cùng tham khảo nhé
1. Bảng Tính Tan là gì?
Bảng Tính Tan là bảng dùng để thể hiện tính tan hay không tan của một chất (muối, bazo hoặc axit) trong nước. Chất đó có thể tan, ít tan hoặc không tan. Bảng tính tan hóa học chuẩn sẽ biểu diễn trạng thái tan hay không tan của một chất ở nhiệt độ 25,15 °C (hoặc 293.15 °K) dưới áp suất là 1 atm.
2. Bảng Tính Tan Của Các Axit – Bazơ – Muối trong nước
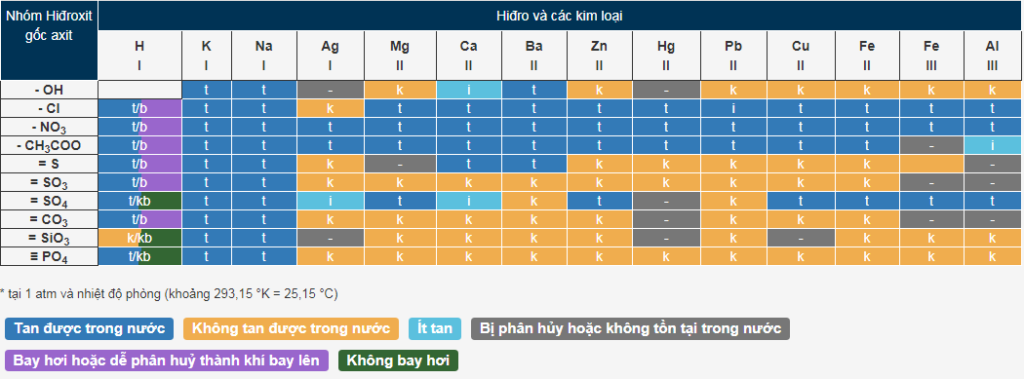
Trong đó:
- t : hợp chất tan được trong nước.
- k : hợp chất không tan.
- i : hợp chất ít tan.
- b : hợp chất bay hơi hoặc dễ phân hủy thành khí bay lên.
- kb : hợp chất không bay hơi.
- vạch ngang “–” : hợp chất không tồn tại hoặc bị phân hủy trong nước.
3. Cách đọc bảng tính tan

-> Tính tan trong nước của chất đó
– Hợp chất tạo bởi kim loại Na (I) và nhóm hiđroxit (– OH) là NaOH, hợp chất này tan trong nước.
– Tương tự ta có: AgCl (k) không tan trong nước, Ag2SO4 (i) ít tan trong nước, HCl (t/b) là hợp chất tan trong nước và dễ phân hủy thành khí khi bay lên, H2SO4 (t/kb) là hợp chất tan trong nước và không bay hơi, AgOH (–) là hợp chất không tồn tại.

II. Ví Dụ Dạng Bài Tập Vận Dụng Sử Dụng Bảng Tính Tan Hóa Học.
PHÂN BIỆT VÀ NHẬN BIẾT CÁC CHẤT
Đây là một trong những dạng rất đặc trưng áp dụng bảng tính tan.
1. Phương pháp giải:
- Bước 1: Tạo mẫu thử – Chia các chất cần phân biệt vào các ống nghiệm rồi đánh số thứ tự.
- Bước 2: Chọn thuốc thử thích hợp (tùy thuộc vào yêu cầu của đề bài).
- Bước 3: Nhỏ thuốc thử vào các ống nghiệm, quan sát hiện tượng xảy ra (kết tủa, bay hơi, đổi màu…), sau đó rút ra kết luận về tên của chất đó.
- Bước 4: Viết PTHH minh họa.
2. Cách nhận biết một số chất thường gặp.
a. Đối với chất khí.
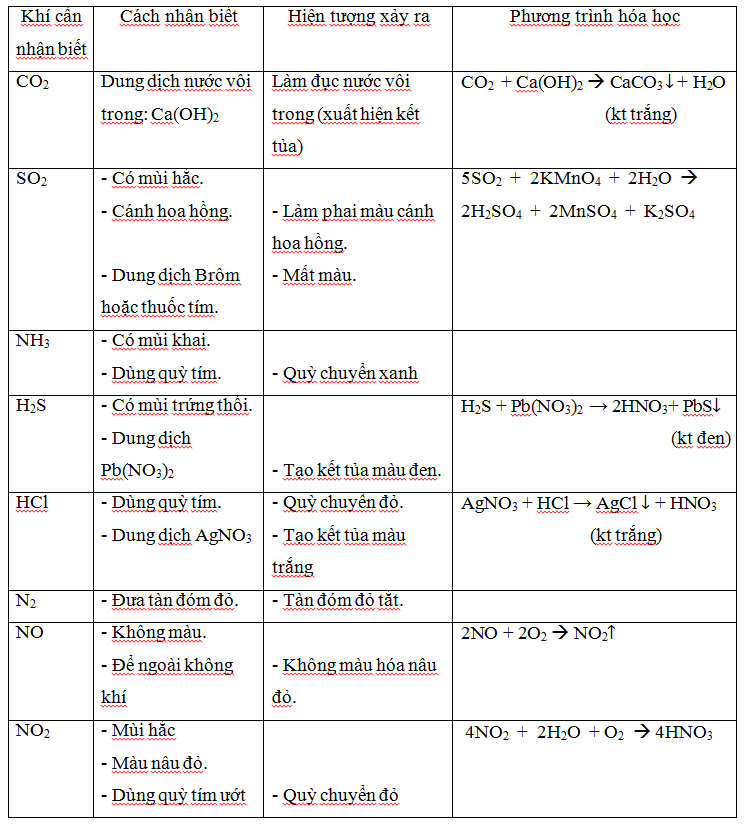
b. Nhận biết dung dịch bazơ (kiềm):
Cách nhận biết chung: Làm quỳ tím chuyển xanh.
Một số cách khác:
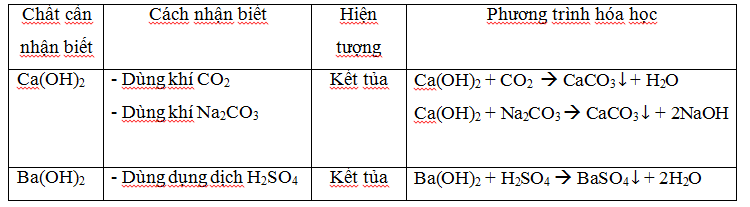
c. Nhận biết dung dịch axit:
Cách nhận biết chung: Làm quỳ tím hóa chuyển đỏ
Một số cách khác:
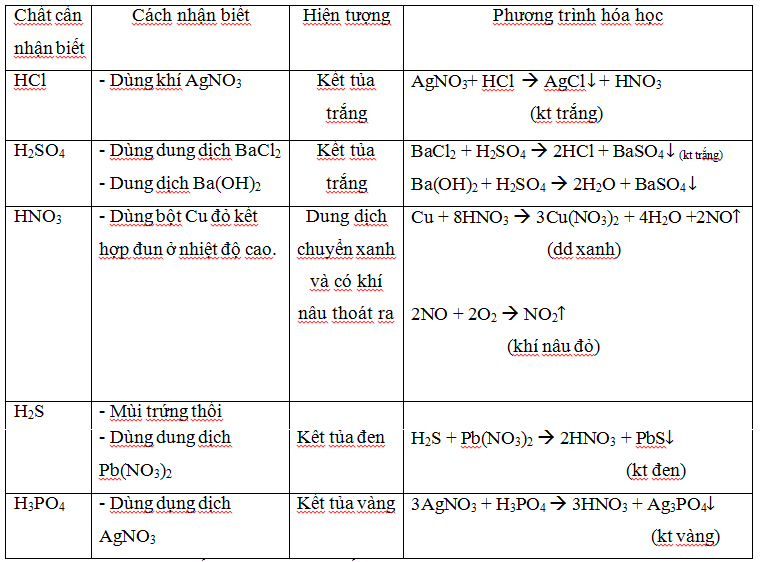
d. Nhận biết các dung dịch muối.
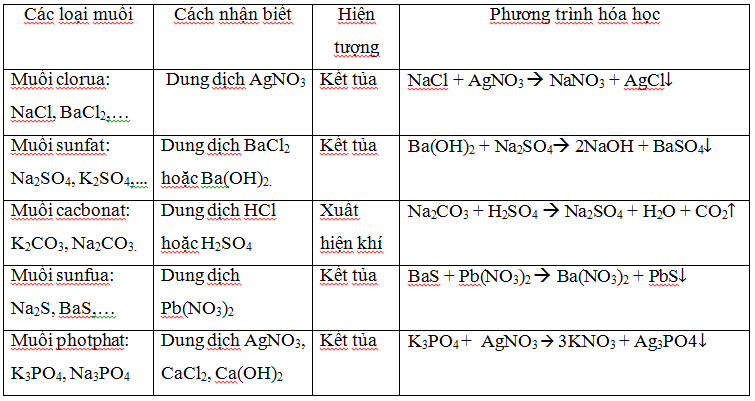

e. Nhận biết các oxit kim loại.
Cho hỗn hợp các oxit
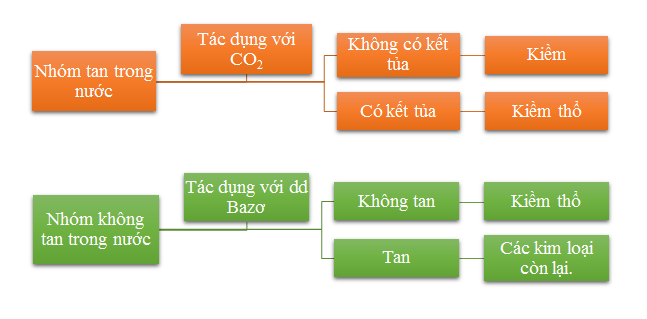
Phương pháp nhận biết: Hòa tan từng oxit vào nước để chia thành nhóm các oxit tan và không tan từ đó có các cách nhận biết riêng biệt.
– Nhóm tan trong nước: dùng khí CO2 để nhận biết
- Nếu không có kết tủa: kim loại trong oxit là kim loại kiềm.
- Nếu có kết tủa: kim loại trong oxit là kim loại kiềm thổ.
– Nhóm không tan trong nước cho tác dụng với dung dịch bazơ.
- Nếu oxit không tan trong dung dịch kiềm thì kim loại trong oxit là kim loại kiềm thổ.
- Nếu oxit tan trong dung dịch kiềm thì kim loại trong oxit là Mg, Zn, Pb, Cu, Fe, Al. (dựa vào bảng tính tan để xác định).
3. Một số dạng bài tập vận dụng.
a. Dạng 1: Dạng bài tập không hạn chế thuốc thử hoặc phương pháp sử dụng:
Phương pháp giải: Sử dụng bảng tính tan hóa học hoặc các gợi ý ở phần trước.
Ví dụ:
Hãy nhận biết 4 lọ mất nhãn đựng 4 loại dung dịch sau: NaCl, NaOH, Na2CO3, NaNO3.
Giải:
- Chia 4 loại dung dịch vào 4 ống nghiệm khác nhau rồi đánh số thứ tự từ 1 đến 4.
- Cho quỳ tím vào 4 ống nghiệm, nếu dung dịch trong ống nghiệm nào làm quỳ tím chuyển xanh thì chất đó là NaOH.
- Tiếp theo, cho dung dịch AgNO3 vào 3 ống nghiệm chứa 3 dung dịch còn lại, dung dịch trong ống nghiệm nào xuất hiện kết tủa, dung dịch đó là NaCl.
PTHH: NaCl + AgNO3 -> NaNO3 + AgCl
- Cho dung dịch HCl vào ống nghiệm chứa 2 chất còn lại là Na2CO3 và NaNO3, chất nào có khí bay lên, chất đó là Na2CO3, chất nào không xảy ra hiện tượng là NaNO3.
PTHH: Na2CO3 + HCl -> NaCl + H2O + CO2
b. Dạng 2: Dạng bài tập hạn chế thuốc thử hoặc phương pháp sử dụng.
Phương pháp giải:
- Đối với dạng bài chỉ sử dụng thêm một chất thử tự chọn:
- Bước 1: Sử dụng một chất bất kì để xác định một trong các chất đã cho ở đề bài.
- Bước 2: Sử dụng chất đã xác định được để nhận biết các chất còn lại.
- Đối với dạng bài không sử dụng thuốc thử nào khác:
- Cách 1: Sử dụng tính chất vật lý của từng chất để phân biệt (mùi, màu sắc, tính tan…)
- Cách 2: Sử dụng chất đã xác định được để nhận biết các chất còn lại.
- Cách 3: Có thể sử dụng phương pháp đun nhẹ để nhận biết các chất dựa vào khả năng bay hơi.
- Cách 4: Cho các chất tác dụng với nhau để nhận biết dựa vào hiện tượng của chúng.
Ví dụ 1: Chỉ dùng thêm một chất thử duy nhất (tự chọn) hãy nhận biết 4 dung dịch đựng trong các lọ mất nhãn sau: Na2CO3, Na2SO4, H2SO4 và BaCl2.
Giải:
- Chia 4 dung dịch vào 4 ống nghiệm khác nhau đánh số từ 1 đến 4.
- Cho quỳ tím vào từng ống nghiệm, dung dịch trong ống nghiệm nào làm quỳ chuyển đỏ, dung dịch đó là H2SO4.
- Dùng dung dịch H2SO4 vừa nhận biết được, cho vào 3 ống nghiệm chứa 3 chất còn lại.
- Chất nào có khí bay lên, chất đó là Na2CO3.
PTHH: Na2CO3 + H2SO4 -> Na2SO4 + H2O + CO2
- Chất nào xuất hiện kết tủa, chất đó là BaCl2.
PTHH: BaCl2 + H2SO4 -> BaSO4 + 2HCl
- Chất nào không có hiện tượng xảy ra, chất đó là Na2SO4.
Ví dụ 2: Không dùng thêm một chất thử nào khác, hãy nhận biết 4 dung dịch sau: NaHCO3, CaCl2, Na2CO3, Ca(HCO3)2.
Giải:
- Chia 4 dung dịch vào 4 ống nghiệm khác nhau đánh số từ 1 đến 4.
- Ta cho các dung dịch tác dụng với nhau, sau đó quan sát hiện tượng để nhận biết.
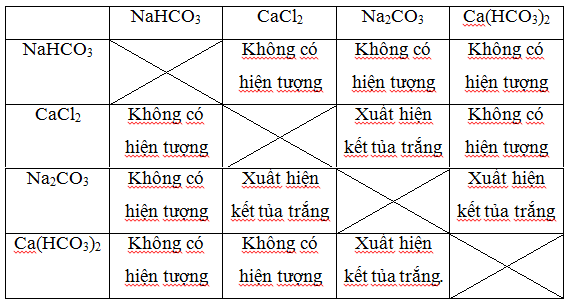
Dựa vào bảng hiện tượng trên ta thấy:
- Chất tạo ra 2 lần kết tủa màu trắng là Na2CO3.
PTHH: Na2CO3 + CaCl2 -> 2NaCl + CaCO3
Na2CO3 + Ca(HCO3)2 -> 2NaHCO3 + CaCO3
- Chất không tạo ra kết tủa lần nào là NaHCO3
- Chất tạo ra 1 lần kết tủa màu trắng là 2 chất Ca(HCO3)2 và CaCl2.
- Tiếp theo, ta đun nhẹ 2 dung dịch còn lại, dung dịch nào tạo kết tủa trắng và có khí bay lên là Ca(HCO3)2.
PTHH: Ca(HCO3)2 -> CaCO3 + CO2 + H2O
III. Một Số Cách Ghi Nhớ Bảng Tính Tan.
1. Axit: Hầu hết các axit đều tan được trong nước, trừ axit silixic (H2SiO3).
2. Bazơ: Phần lớn các bazơ không tan trong nước, trừ một số bazơ như: KOH, NaOH, Ba(OH)2, còn Ca(OH)2 thì ít tan.
3. Muối:
- Muối Natri (Na), Kali (K) đều tan.
- Muối nitrat ( – NO3) đều tan.
- Phần lớn các muối clorua ( – Cl), sunfat ( – SO4) đều tan được trừ AgCl (không tan), PbCl2 (ít tan), BaSO4 và PbSO4 (không tan), Ag2SO4 và CaSO4 (ít tan).
- Phần lớn muối cacbonat đều không tan trừ muối K2CO3 và Na2CO3 (tan).
![]()

Bình Luận Facebook
Tư vấn gia sư (24/7) 097.948.1988

Các tin liên quan
- TOP 10 câu hội thoại tiếng Anh phổ biến nhất 2016
- Bảng Tuần Hoàn Các Nguyên Tố Hóa Học Lớp 8 9 10
- Hiệp Định GIƠ-NE-VƠ : Hoàn cảnh, nội dung và ý nghĩa lịch sử
- Dàn Ý Bài Văn Tả Bố Của Học Sinh Giỏi 2025 Kèm Văn Mẫu
- Một Số Hình Ảnh Về Trường Ngôi Sao Hà Nội
- Bài Văn Mẫu và Dàn Ý Nghị Luận “Chí Khí Anh Hùng”
- Dàn Ý Bài Văn Tả Giờ Ra Chơi Hàng Ngày Của Trường Em
- Kinh Nghiệm Học Tiếng Anh SIÊU hiệu quả
Phụ huynh quan tâm
- Chứng chỉ IELTS là gì? Lợi ích của IELTS và những tổ chức cấp IELTS uy tín
- Thay Đổi Cách Thức Thi THPT môn Toán Và Những Lưu Ý
- Địa chỉ cung cấp gia sư dạy tại nhà ở Hà Nội tốt nhất
- Giúp bạn tìm CÁCH HỌC GIỎI
- Gia Sư Toán Ôn Thi Đại Học Giỏi Nhất Tại Hà Nội, HCM
- Gia sư khu vực Mỹ Đình, Từ Liêm – Hotline : 097.948.1988
- Gia Sư Cho Bé Lớp 1 Uy Tín, Chất Lượng Cao Tại Hà Nội
- Test





